-
Что такое GDPR?
-
Какую роль играет GDPR в клинических испытаниях?
-
Регламент клинических испытаний Европейского Союза
-
Аварийное восстановление в здравоохранении имеет большое значение
-
FAQs о клинических испытаниях в соответствии с GDPR
-
Заключение
Клинические исследования способствуют постоянному совершенствованию диагностических и лечебных методов и являются неотъемлемой частью медицинского прогресса. Неотъемлемой частью клинических исследований также являются лабораторные анализы и обследования пациентов. В этом процессе обрабатываются большие объёмы медицинских и генетических данных, поэтому соблюдение законов о защите данных имеет критически важное значение.
С момента вступления в силу GDPR в странах Европы медицинские учреждения и технологические компании провели масштабную модернизацию своих традиционных рабочих моделей, чтобы обеспечить более тесную взаимосвязь медицинских услуг и повысить их ориентацию на пациента.
Что такое GDPR?
Общий регламент по защите данных (GDPR) — это нормативный акт Европейского Союза, направленный на защиту конфиденциальности и персональных данных физических лиц в пределах ЕС и Европейской экономической зоны (ЕЭЗ). Он вступил в силу 25 мая 2018 года с целью предоставить гражданам больший контроль над их персональной информацией и упростить нормативную среду для международного бизнеса, унифицировав законы о защите данных по всей Европе. GDPR устанавливает строгие требования к сбору, обработке, хранению и передаче персональных данных.
Согласно GDPR, организации обязаны получать явное согласие от пользователей на обработку их данных, предоставлять им право на доступ, исправление и удаление данных, а также сообщать о любых утечках данных в течение 72 часов. Несоблюдение регламента может привести к значительным штрафам — до 4% от мирового годового оборота компании или €20 миллионов (в зависимости от того, какая сумма больше). Регламент делает акцент на прозрачности, подотчётности и безопасности, обеспечивая защиту прав на конфиденциальность данных и создавая условия для ведения бизнеса в глобальной цифровой экономике.
Какую роль играет GDPR в клинических испытаниях?
Согласно GDPR, медицинские данные относятся к категории чувствительных данных. Обеспечение обмена медицинской информацией между странами ЕС становится всё более важным в сфере общественного здравоохранения. Основные меры в этом направлении включают предоставление медицинской помощи и лечения, предотвращение серьёзных трансграничных угроз для медицинских данных, а также обеспечение высоких стандартов здравоохранения, качества и безопасности медицинских продуктов и устройств. GDPR устанавливает правила для законной и безопасной обработки и обмена медицинскими данными внутри ЕС, а также регулирует доступ третьих сторон к данным пациентов, включая выписки, электронные рецепты и долгосрочные электронные медицинские карты, а также использование этих данных в научных исследованиях.
Передача данных клинических исследований за пределы страны включает в себя множество аспектов, таких как национальные законы, нормативные акты и меры защиты конфиденциальности. Например, в США трансграничная передача данных клинических исследований регулируется Законом о переносимости и подотчётности медицинского страхования (HIPAA), который направлен на обеспечение безопасности и конфиденциальности медицинской информации. HIPAA требует, чтобы при передаче персональных медицинских данных за рубеж уровень их защиты соответствовал стандартам США. В ЕС для трансграничной передачи персональных данных, включая данные клинических исследований, действует GDPR. Большинство стран за пределами ЕС также требуют, чтобы передаваемые данные были защищены на уровне, аналогичном внутренним стандартам.
В сфере децентрализованных клинических исследований (DCT) GDPR также играет важную роль. Электронные подписи всё чаще используются в DCT-сценариях, а в некоторых странах и регионах требуется верификация личности участников через видеосвязь при предоставлении электронной подписи. В зависимости от уровня риска и характера вмешательства в клиническом исследовании могут потребоваться различные виды электронной подписи, при этом все электронные формы согласия и электронные подписи должны соответствовать требованиям GDPR. Обычно рекомендуется, а в некоторых случаях является обязательным, проведение оценки воздействия на защиту данных (DPIA) для анализа рисков с точки зрения конфиденциальности при использовании электронных форм согласия.
Кроме того, собранные данные должны соответствовать тем же стандартам надлежащей клинической практики (GCP), что и данные, собранные любыми другими методами. В случае возникновения вопросов к качеству данных может потребоваться дополнительный мониторинг. Вся обработка персональных данных в рамках DCT должна строго соответствовать требованиям GDPR.
Регламент клинических испытаний Европейского Союза
Регламент Европейского Союза о клинических исследованиях (Clinical Trials Regulation, CTR) направлен на унификацию и совершенствование процесса проведения клинических испытаний в странах ЕС. Он был введён для повышения безопасности пациентов, увеличения прозрачности и упрощения процедуры одобрения клинических исследований, что особенно важно в условиях стремительного развития медицинской науки. Регламент вступил в силу 31 января 2022 года, заменив ранее действовавшую Директиву о клинических исследованиях.
CTR внедряет централизованную систему подачи заявок на проведение клинических исследований на уровне ЕС, что ускоряет процесс одобрения и снижает административную нагрузку на спонсоров. Кроме того, он требует повышения прозрачности — результаты клинических исследований теперь должны быть в открытом доступе в Реестре клинических исследований ЕС. Регламент также усиливает защиту участников испытаний, вводя более строгие процедуры получения информированного согласия и более жёсткий контроль за ходом исследований. Помимо этого, CTR упрощает проведение многонациональных исследований, позволяя компаниям эффективнее организовывать испытания в нескольких странах ЕС одновременно.
Аварийное восстановление в здравоохранении имеет большое значение
Клинические испытания в сфере здравоохранения движутся в направлении цифровизации и децентрализации, с ростом объема данных и более глубоким международным сотрудничеством. Восстановление после катастроф играет ключевую роль в клинических испытаниях, так как оно обеспечивает безопасность данных, непрерывность испытаний и соблюдение нормативных требований. Это помогает предотвратить провалы испытаний или риски для пациентов, вызванные потерей данных или сбоями системы.
Vinchin Backup & Recovery разработано для удовлетворения потребностей организаций здравоохранения в защите данных, сталкивающихся с цифровой трансформацией. С поддержкой нескольких платформ виртуализации, таких как VMware, Proxmox, XensServer, Oracle, Hyper-V и популярных баз данных, Vinchin гарантирует высокую доступность и безопасные резервные копии данных. Функции, такие как удаление дубликатов, сжатие и интеграция с облаком, помогают оптимизировать хранение и улучшить время восстановления. Кроме того, Vinchin соответствует регулирующим требованиям, таким как GDPR, обеспечивая защиту конфиденциальной информации и непрерывность бизнеса в случае катастроф. Это позволяет организациям здравоохранения сосредоточиться на оказании медицинской помощи пациентам, сохраняя при этом надежную защиту данных.
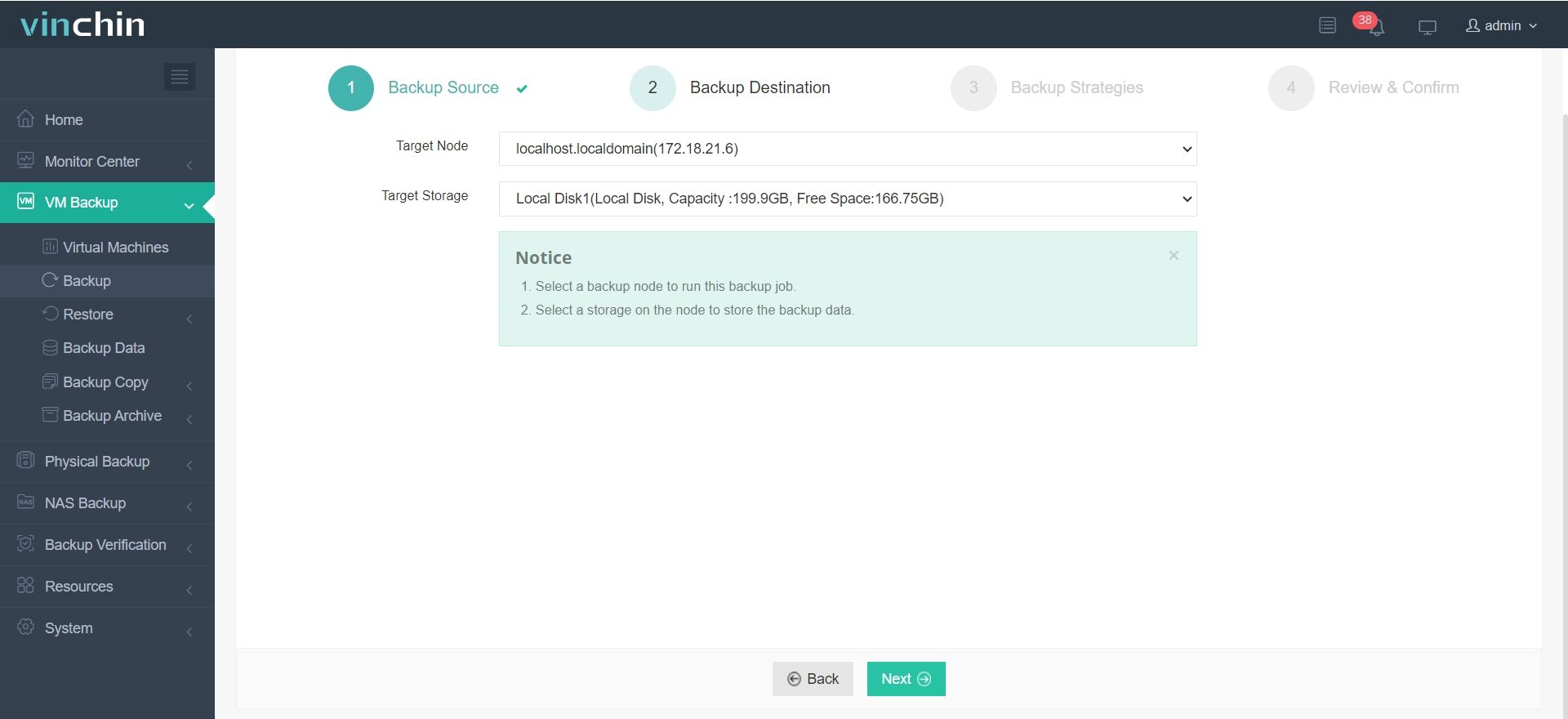
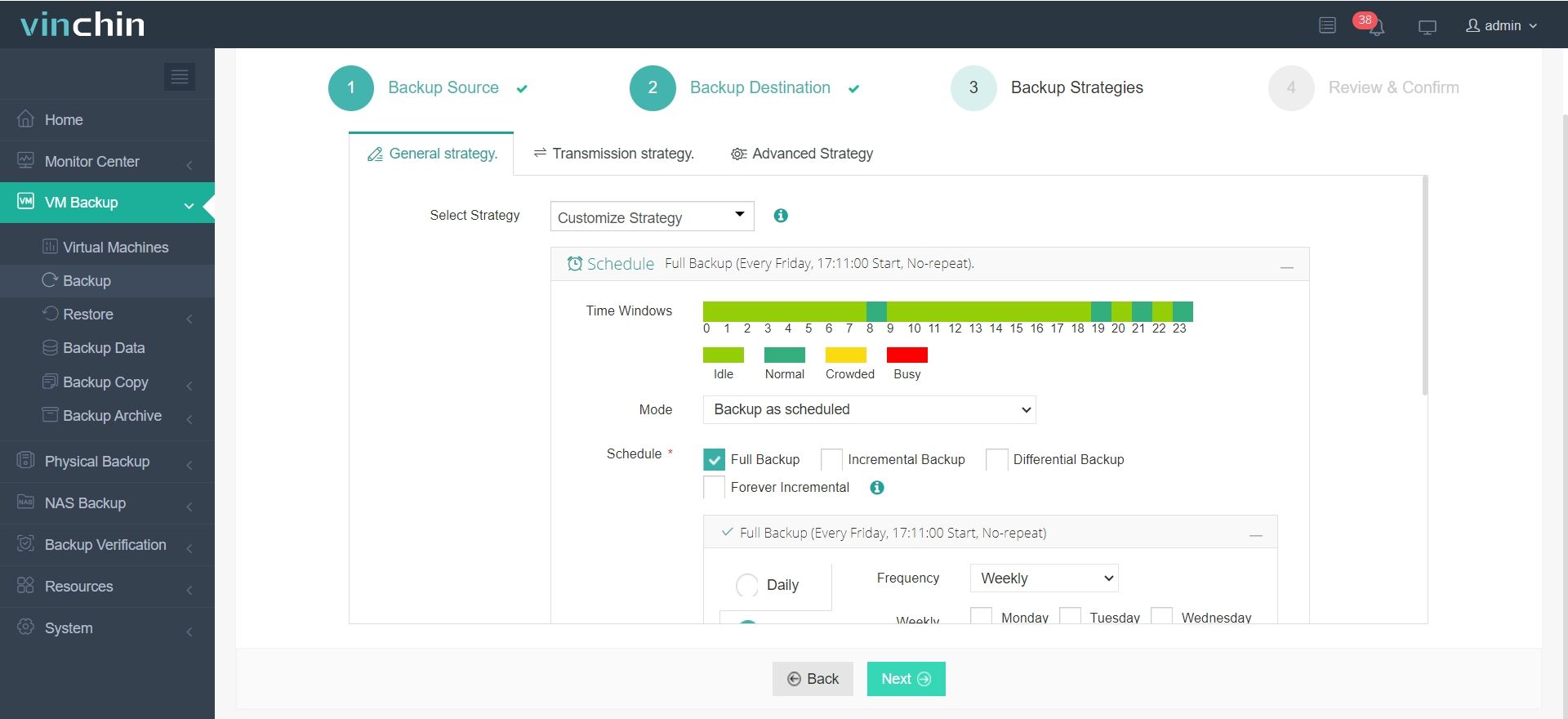
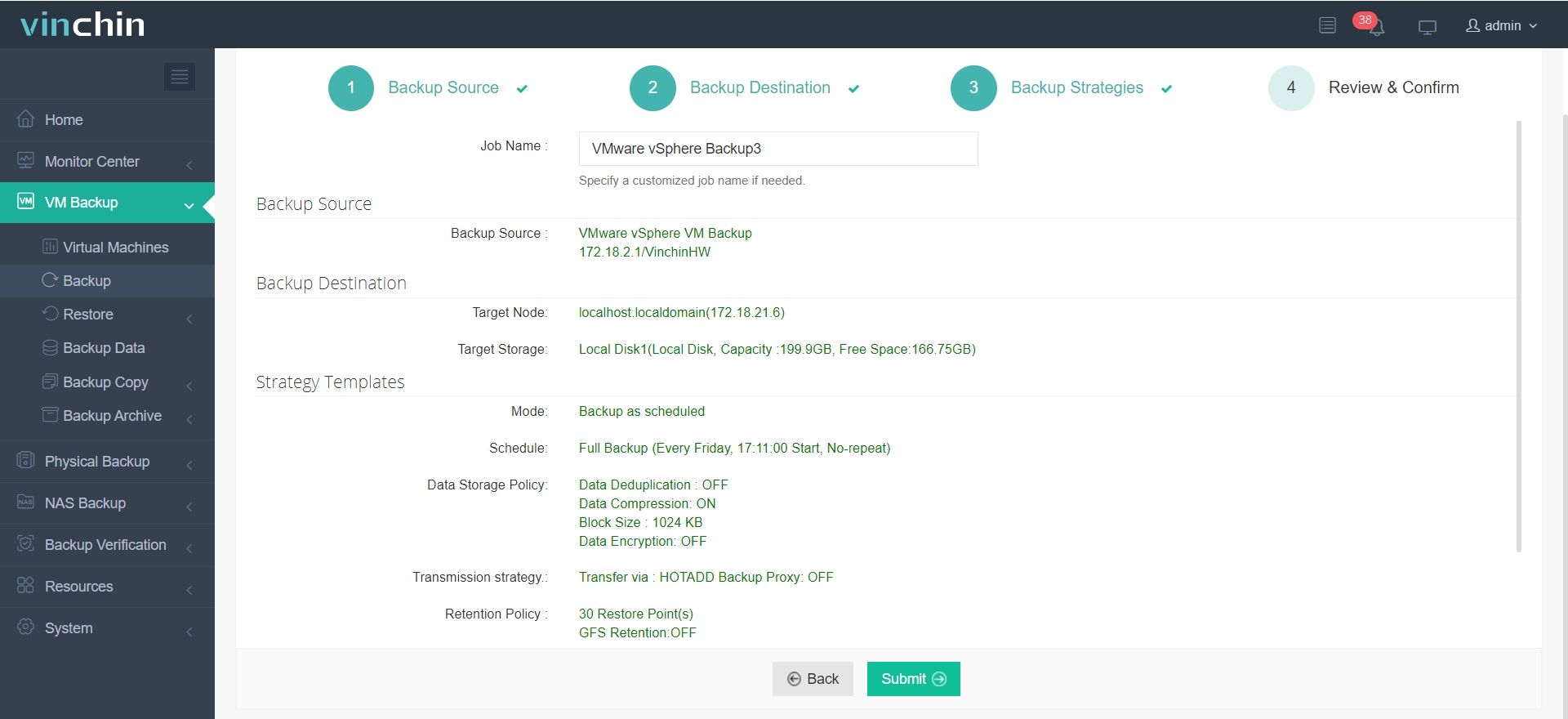
Для создания резервной копии вашей виртуальной машины или базы данных с помощью Vinchin Backup & Recovery требуется всего 4 шага:
1. Выберите объект резервного копирования.
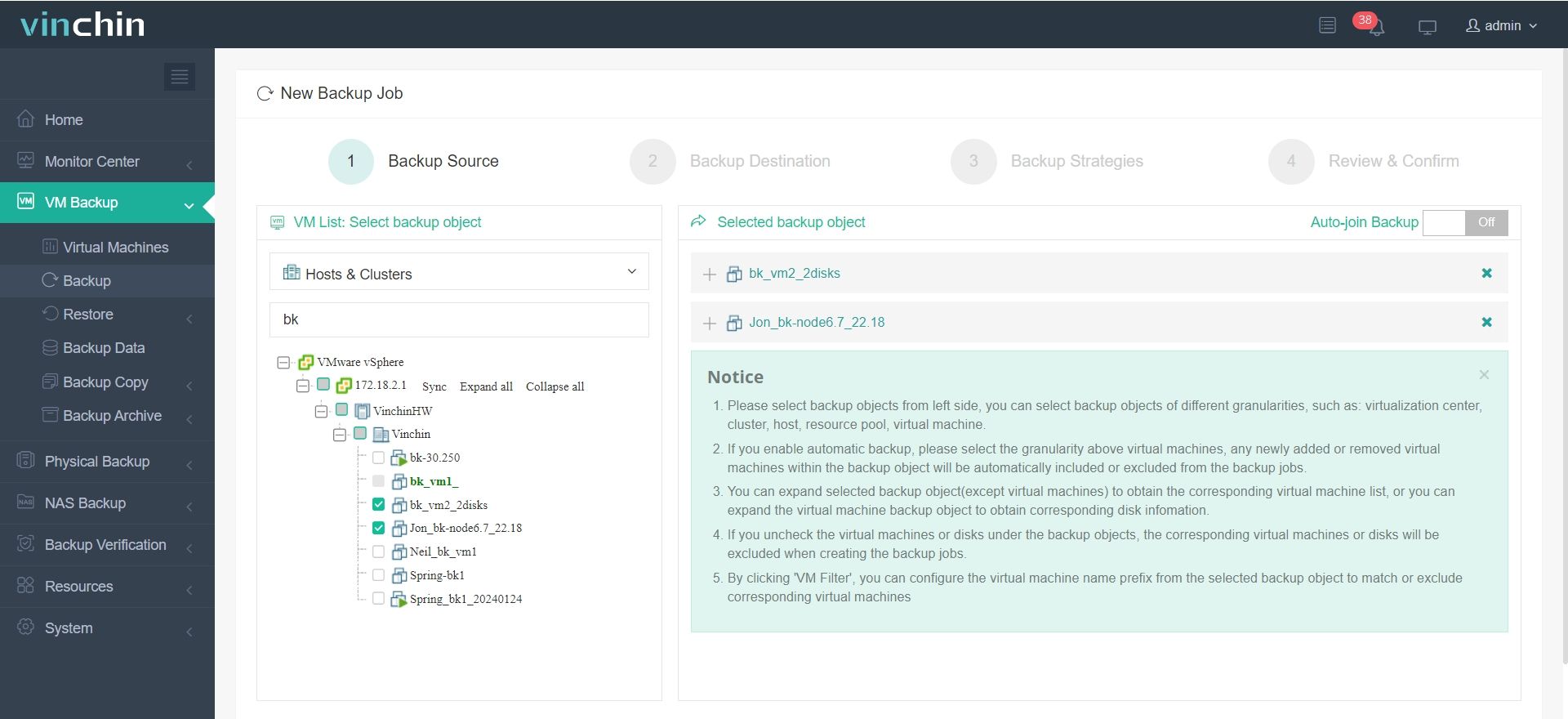
2.Выберите место назначения резервной копии.
3. Настройте стратегии резервного копирования.
4. Проверьте и отправьте работу.
Испытайте возможности этого комплексного системы лично с помощью бесплатной пробной версии на 60 дней! Укажите свои конкретные потребности, и вы получите индивидуальное решение, идеально подходящее под вашу ИТ-инфраструктуру.
FAQs о клинических испытаниях в соответствии с GDPR
1. В чем разница между GDPR и CTR?
GDPR сосредотачивается на защите данных и конфиденциальности, в то время как CTR регулирует проведение клинических испытаний в ЕС. Однако эти два регулирования пересекаются, и требуется соблюдение обоих.
2. Могут ли участники отзыва consent для обработки данных после начала испытания?
Да, участники могут в любой момент отозвать свое согласие на обработку данных. Однако это не влияет на законность обработки, которая была проведена до отзыва. Спонсоры должны информировать участников об этом праве во время процесса получения согласия.
Заключение
В клинических испытаниях защита конфиденциальности участников является уважением к их фундаментальным правам и необходимым условием соблюдения законов и этических стандартов различных стран. Исследователи и учреждения должны обеспечить, чтобы все сбор, хранение, использование и обмен данными соответствовали юридическим нормам и принимать эффективные меры для защиты личной информации и безопасности конфиденциальности участников.
поделиться: